Океан под микроскопом

Гидродинамики привыкли иметь дело с «идеальной жидкостью». И нередко при построении гидродинамических моделей океана совершенно забывают о том, что океан заполнен водой — жидкостью отнюдь не идеальной. К тому же океан — это и не только вода, это растворенные соли, взвешенные минеральные частицы, коллоиды, газы, органическое вещество. Причем все компоненты находятся в сложнейшем взаимодействии.
Мы, океанологи, не можем изучать эту многокомпонентную систему в целом — она слишком сложна. Беда в другом — нередко мы словно забываем, что она вообще существует. В некоторых случаях мы продолжаем закрывать глаза на давно известные факты. Однако в связи с развернувшимися в последние годы исследованиями делать это все труднее. А почему — читателю должно стать ясно по прочтении статьи.
Обыкновенная вода
Химики шутят: нет в природе вещества более грязного, чем чистая вода. Что может быть проще? Н20 — два атома водорода соединены с атомом кислорода. Химическое вещество, которое покрывает более семидесяти процентов поверхности земного шара… Химическое вещество, которое течет из кранов водопровода в нашей квартире… Трудно поверить в его необыкновенность! Обыкновенная вода?
Со школьной скамьи мы знаем, что свойства всех химических элементов и их соединений определяются положением элементов в периодической системе Д. И. Менделеева. Вы помните, в 1870 году великий ученый, демонстрируя могущество созданной им системы, впервые в истории химии предсказал существование еще не известных науке элементов: экабора, экаалюминия и экасилиция. Мало того, он предсказал свойства этих элементов и их соединений.
Конечно, никто в наши дни не сомневается в справедливости периодического закона. Его современная формулировка записана золотыми буквами на скрижалях науки: «Свойства химических элементов в образуемых ими простых и сложных соединениях находятся в периодической зависимости от величины заряда их атомных ядер».

Попробуем, руководствуясь периодическим законом, определить элементарные свойства воды — гидрида кислорода. На таблице Менделеева кислород стоит в Via группе. Аналоги кислорода: сера, селен, теллур. Аналоги воды (Н20) — гидриды: H2S, H2Se, Н2Те. Свойства этих гидридов, действительно, закономерно изменяются. И исходя из них, мы находим, что, например, температура плавления четвертого гидрида — воды — около минус 100 градусов. Но мы-то знаем, что лед плавится при 0 градусов! Точно так же мы найдем, что вода должна кипеть при температуре минус 80 градусов. Разница еще более впечатляющая — вода кипит при плюс 100 градусов!
Не надо, конечно, ставить под сомнение закон. Просто вода — редчайшее исключение из правил. Фактически все ее свойства даже не просто аномальны, а уникальны.
- Теплоемкость воды — наиболее высокая среди всех твердых и жидких веществ, за исключением жидкого аммиака и водорода.
- Скрытая теплота плавления — наиболее высокая из всех веществ, за исключением тех же жидкого аммиака и водорода.
- Скрытая теплота испарения — наиболее высокая из всех веществ (уже без всяких исключений).
- Поверхностное натяжение — наиболее высокое из всех жидкостей.
- Теплопроводность — наиболее высокая из всех жидкостей…
Этот список можно и продолжить, но вы, наверное, уже понимаете, что шутка химиков имеет очень серьезные основания. Нет вещества более необыкновенного, более удивительного и загадочного, чем обыкновенная вода!
Почему она течет!
К сожалению, шутка окрашена грустью — объяснить причины аномальности воды не удается. Во всяком случае, объяснить до конца. Многое, конечно, понятно. Первая причина — строение самой молекулы.
Можно было бы думать, что молекула линейна, то есть имеет вид:
Н — О — Н
Но в действительности связи О—Н образуют между собой некоторый угол, и молекула имеет вид:
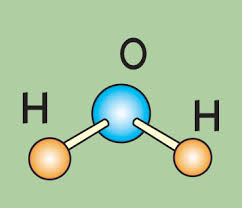
Атомы водорода несут на себе некоторый положительный заряд, а атом кислорода — отрицательный. Поэтому каждая молекула представляет собой диполь — крохотный магнитик: +—
Уточняя эту картину, молекулу воды можно представить себе в виде неправильного четырехлопастного винта. На оси ее «насажено» ядро атома кислорода, две соседние лопасти оканчиваются положительно заряженными атомами водорода, а две другие — двумя парами отрицательно заряженных электронов.
Разноименно заряженные лопасти соседних молекул охотно притягиваются друг к другу, так что в принципе каждая из молекул может быть связана с четырьмя другими. Именно эти связи определяют внутреннюю межмолекулярную структуру — вторую и главную причину аномальных свойств воды.
Ученые знают структурные формулы сотен тысяч химических веществ, даже таких сложных, как ДНК, которая ответственна за наследственность. Но межмолекулярная структура «обыкновенной» воды по-прежнему не поддается расшифровке. Воистину «поразительна сила человеческого разума, но еще более поразительна сложность вопросов, которые ставит перед человеком природа»! Предложены уже десятки гипотез, объясняющих аномальность воды. Среди их авторов немало крупнейших ученых: Бернал, Полинг, Попл… Гипотезы, как заметил американский химик Р. Хорн, «продолжают появляться с угрожающей скоростью», что само по себе свидетельствует об их несовершенстве.
Как ни удивительно, но совсем не просто объяснить такое обыденное свойство воды, как… текучесть. Вообще все затруднения связаны именно с жидкой водой.
Водяной пар — это хорошо известно — состоит из отдельных (мономерных) молекул с небольшой примесью димеров и еще меньшей — тримеров.
Напротив, лед имеет очень жесткую структуру. Каждый атом кислорода связан водородными связями с четырьмя (помните — четырехлопастный винт) другими атомами кислорода, которые располагаются в вершинах тетраэдра.

Изысканное изящество снежинок и морозных узоров на окнах — следствие правильной кристаллической структуры льда. Лед — кристалл, ни о какой текучести здесь не может быть и речи. Однако есть серьезные основания предполагать, что и в жидкой воде сохраняется жесткая льдоподобная структура.
Забегая вперед, придется сказать, что для испарения грамма воды необходимо затратить около 540 калорий, а для плавления грамма льда — только около 80. В первом случае (при испарении) должны быть разорваны все межмолекулярные связи (водяной пар, как вы помните, мономерен). Сопоставление чисел 540 и 80 наводит на мысль, что при плавлении льда по крайней мере пять из шести водородных связей остаются неразорванными. А значит, и в жидкой воде сохраняется льдоподобная структура.
Исходя из этого, ученый О. Я. Самойлов еще около тридцати лет назад предложил одну из наиболее совершенных теорий межмолекулярной структуры воды. Самойлов подчеркивает, что ажурная решетка льда содержит внутри своего каркаса достаточно большие полости (расстояние между атомами кислорода больше, чем «размер» одиночной молекулы). При плавлении льда часть решетки разрушается, а отдельные свободные молекулы могут попадать внутрь каркаса.
Все мы привыкли видеть плавающий лед и считаем, что это, вроде бы, само собой разумеется. На самом же деле мы сталкиваемся здесь с еще одной аномалией воды. Плотность всех твердых веществ при плавлении уменьшается, и потому они всегда тяжелее своей жидкой фазы, всегда тонут в собственном расплаве.
Лед легче воды, и это находит вполне логичное объяснение в теории Самойлова. Действительно, плотность должна увеличиваться, если свободные молекулы заполняют пустоты в льдоподобном каркасе. Ведь упаковка становится более плотной. Можно объяснить и другие аномалии, но некоторые недоуменные вопросы все же остаются.
Еще более трехсот лет назад именно температура замерзания воды была принята за отсчетную точку — ноль градусов. Считалось, что она всегда постоянна. Однако вода, как выясняется, очень «не любит» замерзать. Воду легко переохладить, если предварительно удалить из нее растворенные газы (например, тщательно прокипятить). В лабораторных опытах, даже охладив воду до минус семидесяти градусов, удается избежать появления льда. Но стоит опустить в сосуд кристаллик льда, как тут же поверхность воды мгновенно замерзнет, а температура самой воды «подскочит» до ноля градусов.
— Необходимо присутствие центров кристаллизации,— говорят ученые,— Это может быть и кристаллик льда, и песчинка, и крохотный пузырек воздуха.

Но почему же центром кристаллизации не может быть сама льдоподобная структура, если она сохраняется в жидкой воде? И, во-вторых, если жесткая льдоподобная структура почти целиком сохраняется, то как объяснить текучесть жидкой воды?
Оставим, впрочем, в стороне теоретические дискуссии — вода аномальна, хотя мы и не понимаем до конца причины этого. Важно, что именно необыкновенность воды делает наш мир таким, как он есть.
Мир без воды!
Его трудно, пожалуй, даже невозможно представить при самом пылком воображении. Поставим перед собой более скромную задачу — поговорим подробнее о значении отдельных аномалий воды. Если не очень заботиться о точности формулировок, то теплоемкость можно определить как способность вещества поглощать или отдавать тепло, не изменяя своей температуры, как способность противостоять нагреву или охлаждению.
Для нагревания грамма воды нужно затратить в два раза больше тепла, чем для нагревания грамма любого другого вещества, и почти в десять раз больше, чем для нагревания грамма песка, грунта или скальной породы. Благодаря этому океан в отличие от суши «неохотно» нагревается и «неохотно» отдает тепло. Важность этого обстоятельства трудно переоценить.
Перепад температур на безводной Луне — около двухсот пятидесяти градусов. В земном океане — от экватора и до Северного полюса — около тридцати. Благодаря большой теплоемкости воды океан Земли работает, как гигантский термостат, сглаживая колебания температуры.
Конечно, не только близость к океану имеет значение. Порт Архангельска надолго замерзает, а порт Мурманска, который расположен на полтысячи километров севернее, работает круглый год благодаря теплому Северо-Атлантическому течению, зарождающемуся в Мексиканском заливе.

Обратите внимание, из-за высокой теплоемкости воды течения очень долго сохраняют свою «индивидуальность». Весь Северный Ледовитый океан, например, на глубинах от двухсот до тысячи метров заполнен водами Атлантики, которые годами остаются теплыми, хотя над ними и под ними температуры отрицательные. Теплоемкость воды, а точнее разница в теплоемкостях океана и суши, объясняет возникновение бризовых и муссонных ветров.
Не менее важная особенность воды — уникально высокая скрытая теплота парообразования. Для испарения грамма воды нужно затратить в три раза больше тепла, чем для испарения спирта, и в восемь раз больше, чем для испарения ртути.
Испарить воду очень трудно — на это расходуется большая часть солнечной энергии, приходящей на Землю. В целом по земному шару в атмосферу «возносится» миллиард или более тонн водяного пара. Нет, не за сутки — только за одну минуту!
При конденсации водяного пара в верхних слоях воздуха все тепло, которое было затрачено на испарение, вновь выделяется — ежеминутно 2X1018 джоулей. Чтобы выработать такое количество энергии за одну минуту, потребовалось бы сорок миллионов электростанций мощностью по миллиону киловатт каждая.
Сама атмосфера почти прозрачна для солнечной радиации. Она задерживает не более четвертой части приходящего излучения. Обогревает атмосферу именно тепло, выделяющееся при конденсации водяного пара. Это та энергия, которая питает общую циркуляцию атмосферы, которая порождает ветры и штормы, смерчи и тайфуны.

Тайфун средней силы несет в себе энергию, эквивалентную тридцати — пятидесяти тысячам атомных бомб. Конечно, мы не можем (и сможем ли?) бороться с тайфуном, когда он, зародившись в тропических широтах, начинает двигаться, сметая все на своем пути. Но энергия, которую накопил тайфун, это энергия испарившегося водяного пара. Видимо, когда-нибудь мы сможем предупреждать зарождение грозных вихрей, искусственно уменьшая испарение — в нужный момент и в нужной точке океана. Подобные эксперименты уже начинают проводиться…
Для нас, жителей умеренных широт, очень важное значение имеет и аномально высокая скрытая теплота плавления. Фазовые переходы воды, перестройка ее межмолекулярной структуры мучительны. Из-за них зима отделена от лета весной и осенью. Действительно, лед и снег можно довольно быстро прогреть до температуры таяния. Но чтобы растопить лед и снег, нужно затратить в восемь раз больше солнечного тепла и времени — таяние поглощает уйму энергии.
Немалое значение имеет и то обстоятельство, что незагрязненные, девственно белые поверхности отражают большую часть радиации. Но все-таки в первую очередь именно благодаря высокой теплоте плавления льда существует весна.
При образовании же льда, тепло, наоборот, выделяется — мы нередко забываем об этом. И зима не сразу вступает в свои права. Еще в 1929 году американский профессор X. Шелдон предложил использовать это «забытое» тепло.
«При замерзании кубического метра льда,— писал Шелдон,— выделяется столько же тепла, сколько дает сжигание двадцати двух фунтов угля. Река Святого Лаврентия выносит в море ежедневно больше энергии, чем может быть произведено при сжигании всего угля, добываемого в Канаде в течение года».
Оставим в стороне техническую сторону вопроса — я не берусь оценивать возможности практической реализации проекта. Но, может быть, о нем стоит вспомнить энергетикам? Поговорим о силе, которая кажется несколько нереальной — о силе поверхностного натяжения.
Молекула, находящаяся внутри жидкости, испытывает притяжение соседних молекул во всех направлениях. Если же молекула расположена на самой поверхности, то межмолекулярные связи могут возникать только в нижней полусфере. Молекула как бы втягивается внутрь жидкости.
Поверхностное натяжение воды больше, чем любой другой жидкости. Весьма существенно, что внесение даже минимального количества загрязняющего вещества, как правило, в несколько раз уменьшает поверхностное натяжение воды.
Благодаря этому свойству на поверхности воды даже при легком ветре образуются капиллярные волны. Чаще, впрочем, их называют «рябью» — высота капиллярных волн не превышает десятых долей сантиметра. Рябь как бы собирает «в гармошку» поверхность моря, увеличивая тем самым ее площадь приблизительно в полтора раза. А следовательно, в полтора раза увеличивается и испарение (которое пропорционально этой площади), и поступление тепла в атмосферу. Кстати сказать, рябь и громады штормовых волн делят энергию ветра приблизительно пополам — неожиданность, не правда ли.
Капиллярные явления также очень тесно связаны с поверхностным натяжением. Смачивая стенки тонкой капиллярной трубки, вода образует вогнутую поверхность (вогнутый мениск). Поверхностное натяжение постоянно стремится выпрямить эту вогнутость, и столбик жидкости ползет вверх вопреки силе тяжести. То же самое происходит и в природных капиллярах — в порах грунта и в самих растениях. Благодаря этому грунтовые воды могут подниматься на 10—12 метров выше естественного уровня, поднося влагу к поверхности и питая растения. Земледелие было бы невозможно без капиллярных явлений.

Раствор всех солей
Вода — самый сильный на Земле растворитель. Возможно, это обстоятельство оказалось решающим в сложном процессе зарождения жизни на нашей планете.
Диэлектрическая постоянная чистой воды — наиболее высокая из всех жидкостей. Ее величина равна восьмидесяти — это означает, что два разноименных заряда притягиваются в воде друг к другу с силой в восемьдесят раз меньшей, чем в воздухе.
Прочность вещества определяется межмолекулярными связями — взаимодействием положительных зарядов атомных ядер и отрицательных зарядов электронов. Но каждая молекула воды сама — диполь. Поэтому в веществе, погруженном в воду, межмолекулярные связи ослабляются в восемьдесят раз. Вещество растворяется, либо распадаясь на отдельные молекулы, как сахар, либо — на заряженные ионы, как поваренная соль.
Любой элемент таблицы Менделеева в том или ином количестве можно обнаружить в водах Мирового океана. А суммарная общая соленость в среднем равна трем с половиной процентам, или, как говорят океанологи, тридцати пяти промилле.
Растворенные вещества сами влияют на внутреннюю структуру воды, на ее свойства, причем разные вещества по-разному.
В первом приближении морская вода — просто-напросто 0.5М-раствор поваренной соли. Можно приготовить килограмм морской воды, растворив 29,22 грамма NaCl в 970,78 грамма дистиллированной воды. Проведем опыт в мензурке, заметив предварительно объем воды и вычислив объем соли. Мы сразу же обнаружим, по крайней мере, три замечательных явления. Во-первых, температура воды понизится — на растворение соли, на разрыв связей, будет затрачено около шестисот калорий. Во-вторых, электропроводность резко — более чем в десять тысяч раз — возрастает. И в-третьих, мы с удивлением убедимся, что вода опровергает и правила сложения. Суммарный объем раствора будет на пять миллилитров меньше, чем сумма объемов воды и соли. Раствор как бы сжался.
Резкое возрастание электропроводности объясняется, очевидно, разложением соли на отдельные ионы натрия и хлора, которые и переносят электрические заряды.
Сложнее обстоит дело с уменьшением объема — оно объясняется явлением, которое называется электрострикцией. Кулоновские поля ионов притягивают к себе молекулы воды и тем самым меняют ее внутреннюю структуру. Каждый ион в растворе как бы «облеплен» молекулами воды — гидратирован.
Отчасти именно с электрострикцией связано явление, которое в океанологии называется уплотнением при смешении. Водные массы, даже имеющие одинаковую плотность, но разные температуры и солености, смешиваясь, становятся более плотными и погружаются, формируя глубинные воды.
До сих пор мы говорили об искусственной морской воде — о растворе поваренной соли. Однако в реальном океане растворено великое множество солей, причем не все ионы, подобно ионам натрия и хлора, уплотняют, упорядочивают структуру. Если размеры ионов превышают размеры пустот в льдоподобном каркасе воды, то, стремясь «втиснуться» в пустоту, ионы разрушают каркас. Если к тому же заряд такого иона невелик, то разорванные водородные связи не могут быть замещены взаимодействием иона с оторвавшимися молекулами. Они приобретают большую подвижность, и в целом структура воды становится более рыхлой. К разупорядочивающим ионам относятся, например, ионы калия, рубидия, цезия, брома, йода.
Уплотнение структуры воды при электрострикции можно уподобить действию давления. Вода, хоть и в незначительной степени, но сжимаема. Уменьшение объема на пять миллилитров как это наблюдалось в нашем опыте, может быть достигнуто, если приложить давление около ста атмосфер. На глубине тысяча метров как раз такое давление. Разупорядочивающие ионы, разрушая структуру, как бы уменьшают давление, создают разрежение.
Ученых всегда удивляло, что кашалоты свободно ныряют на глубину тысяча метров и более, не испытывая обычных при погружении трудностей. Недавно было высказано предположение, что на поверхности тела кашалота выделяется какое-то вещество, которое разрушает межмолекулярную структуру воды и ослабляет внешнее давление. Фантастика? Наверное, да, но, может быть, и нет. Животные умеют использовать особенности среды, где они обитают, самым удивительным образом.

Растворенные соли, изменяя структуру воды, изменяют, естественно, и ее свойства. Очень своеобразен, например, процесс замерзания в океане. Вплоть до начала прошлого века ученые всерьез думали, что морская вода вообще не замерзает, что льды Арктики, например, приносятся в океан сибирскими реками. Некоторые разумные основания для подобного заблуждения, конечно, были: китобои, а затем и полярные путешественники не раз могли убедиться, что лед, плавающий в океане,— пресный или почти пресный. А если так, то его речное происхождение не вызывало сомнений.
Мы знаем теперь, что морская вода начинает замерзать при более низкой температуре, чем пресная,— минус 1,9 градуса. Вообще, чем выше соленость, тем ниже температура замерзания. Молодой, только что образовавшийся лед не совсем пресный. Он содержит внутри себя капсулы рассола, что и делает его солоноватым. Но постепенно этот рассол стекает, и лед действительно становится пресным.
А соленость самой морской воды при ледообразовании повышается, следовательно, понижается ее температура замерзания. И если мы поставим лабораторный опыт, то увидим, что толщина льда будет постепенно возрастать, а соленость жидкой фазы увеличиваться. Окончательно вода в пробирке замерзнет только при температуре ниже минус 30 градусов!
Здесь возникает еще один интересный вопрос. Для «обычных» химических веществ справедливо утверждение: чем ниже температура, тем больше плотность вещества. Пресная вода, однако, имеет наибольшую плотность не в точке замерзания, а при температуре плюс 4 градуса.
— Благодаря этому,— учили нас в школе, — у дна озер температура всегда положительная, благодаря этому водоемы не промерзают ежегодно до дна.
Все верно, но как быть с морской водой? Она-то ведет себя как «обычное» вещество. И, скажем, в Антарктике даже километровый слой воды может быть охлажден до температуры замерзания. Но лед все-таки не образуется — почему? Оказывается, увеличение давления тоже влияет на структуру воды и, в частности, понижает температуру замерзания. Для морской воды этот процесс фактически не изучен. А вот пресная вода при повышении давления до 2000 атмосфер замерзает уже при температуре минус 22 градуса. При более высоких давлениях картина становится все более удивительной — сам лед обретает другие свойства. Вначале он становится тяжелее воды и опускается на дно. Затем опять всплывает, а температура его плавления начинает повышаться — до плюс 80 градусов. Существует даже «раскаленная» модификация льда, которая плавится только при температуре 175 градусов!
И океан состоит из молекул
Когда-то, на заре нашей науки, с помощью ареометров определяли реальную плотность морской воды. Теперь мы определяем некоторую фиктивную плотность, рассчитывая ее по солености и температуре. Это верно, точность значительно повысилась — до пятого знака после запятой. Мы вроде бы убеждены — плотность воды в данной точке и на данной глубине 1,02795. На самом деле это некая фикция. Кроме температуры и солености плотность зависит еще и от мутности, от количества взвешенных частиц, микроорганизмов и т. д. Известно, например, что плотность воды желтой реки Хуанхэ может достигать 1,1 г/см3. В мутьевых потоках — они распространяются у дна океана — плотность нередко превышает 1,2 г/см3.

Нужен ли нам пятый знак, если мы не измеряем одновременно мутность воды, если мы за счет этого можем ошибаться в четвертом, третьем или даже втором знаке?
Плотность — важнейшая характеристика воды. По плотности мы рассчитываем течения, глубинную циркуляцию вод. Правильно ли мы представляем ее себе, не зная истинной плотности? А ведь мы еще не учитываем, что взвешенные частицы тоже влияют на структуру воды, а следовательно, и на ее свойства.
Интересные эффекты связаны с выделением так называемой теплоты смачивания. Разве не удивительно — воду можно нагреть, буквально посыпая ее пеплом. Молекулы воды, вступая в контакт с адсорбирующей поверхностью, теряют свою подвижность, связываются, выделяя внутреннюю кинетическую энергию в виде теплоты смачивания. Ее количество зависит от размеров связывающих частиц и их минерального состава. В самом первом приближении можно утверждать, что при выпадении грамма тонкоразмолотых частиц на поверхность воды выделяется до восьмисот и более калорий.
Может ли выделение теплоты смачивания как-нибудь влиять на тепловой режим водоема или Мирового океана в целом? Ответить на этот вопрос трудно, но некоторые оценки возможны.
По мнению ученых, в настоящее время наземные вулканы ежегодно выбрасывают при извержениях приблизительно полтора кубических километра вулканического материала. Это, конечно, совсем немного. Самые приблизительные оценки показывают, что глобальная теплота смачивания в миллион или даже в десять, сто миллионов раз меньше, чем ежегодное поступление солнечного тепла.
Ну, а дальше каждому вольно строить любые гипотезы. Конечно, вулканическая деятельность была в прошлом значительно активнее, Земля могла попасть в облако космической пыли и т. д. Во всяком случае, в геологической истории Земли отмечено несколько случаев резкого обновления водной фауны, которые, по-видимому, совпадают с периодами интенсивного вулканизма.

До недавнего времени казалось, что, изучая реальный океан, вообще можно пренебречь процессами, происходящими на молекулярном уровне. Казалось, что океан турбулизован от поверхности до дна. Какой смысл говорить о молекулярной передаче тепла, если турбулентная теплопроводность в тысячи раз больше? Однако теперь общепринятая точка зрения меняется.
Видимо, в результате молекулярных процессов может возникать конвекция, резко усиливающая перенос тепла.
Проявляются такие тонкие и необычные его механизмы, как, например, двойная диффузия. Океан можно сравнить со слоеным пирогом — отдельные слои отличаются друг от друга по температуре и солености. С течением времени перепад характеристик уменьшается. При этом важно, что температура выравнивается за счет молекулярных процессов приблизительно в сто раз быстрее, чем соленость.
Дальнейшие рассуждения необходимо иллюстрировать схемой. Сначала (а) нижележащий слой имеет более высокую плотность. Казалось бы, конвекции никак не возникнуть, обмен будет целиком происходить за счет молекулярных процессов. Но через некоторое время (б) температура уже успеет выровняться, а соленость еще нет. Нижележащий слой пока еще менее солен, но теперь уже и плотность его стала более низкой. Возникла неустойчивость. Если разность плотности достаточно велика, то в момент (б) обмен может резко усилиться — возникнет своеобразная форма конвекции, которую океанологи называют «солевыми пальцами».
За последние годы во всем мире резко усилился интерес к изучению физико-химических свойств воды — как морской, так и пресной. При этом обнаруживаются новые и весьма неожиданные эффекты.
Показано, например, что урожай огурцов и редиски можно увеличить более чем в два раза, если перед посевом замочить семена на полтора часа в талой воде. Урожай пшеницы при подобной обработке семян увеличивается в полтора раза. Куры, которые пьют талую снеговую воду, несут в два раза больше яиц… Этот список можно и продолжить. Талая вода, как считают многие, обладает особой биологической активностью.
Надо сказать, что океанологи давно уже обратили внимание на исключительную интенсивность жизни вблизи кромки льдов. «Урожайность» планктона в этих районах приблизительно в два раза больше. И, наверное, недаром киты «пасутся» в полярных водах. Интересное наблюдение — несколько лет назад в одной из статей было показано, что киты в своих миграциях по океану двигаются вдоль изогалин, линий равной солености. Видимо, концентрация планктона, за которым охотятся киты, зависит от изменения солености моря при таянии льдов, а не температуры воды.
Вообще вода в живом организме, по-видимому, отличается, большей структурной упорядоченностью по сравнению со свободной водой. Возможно, говорят ученые, талая вода, сохраняющая льдоподобный каркас, требует в связи с этим меньших затрат энергии на усвоение. Впрочем, согласно другой гипотезе, главное для живых организмов — это пониженное содержание в талой воде тяжелого водорода.
До недавнего времени гидрохимиков интересовали преимущественно глобальные проблемы, связанные с распространением в Мировом океане различных элементов или их соединений. Отчасти это понятно — необходимо было представить себе общую картину всей огромной акватории океана и всей его толщи. Но вот недавно я получил автореферат кандидатской диссертации, которая называется «Исследование особенностей химического состава поверхностного микрослоя морских вод и распределения в нем загрязняющих веществ». Автор работы исследует слой океана, толщина которого… меньше одного миллиметра. Конечно, это принципиально иной подход… Океан под микроскопом!
Американский ученый Роберт Хорн счел необходимым начать предисловие к своей книге «Морская химия» парадоксальной фразой: «Океаны состоят из воды». Такое напоминание не кажется излишним и сегодня.
Необходимо тщательно и детально изучать особенности физико-химических свойств воды при самых различных условиях — во всем диапазоне температур, давлений и так далее. Но это не самоцель. Изучив во всей полноте удивительные свойства воды, мы неизбежно откроем новые явления в океане.
Автор: В. Шумилов.

