Ковалентная связь: полярная, неполярная, механизмы ее появления
Содержание:
Определение и характеристика
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» — совместно и «vales» — имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
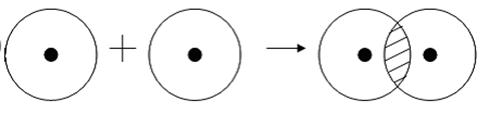
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор — свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
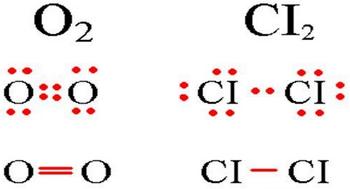
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Так выглядит схема ковалентной полярной связи.
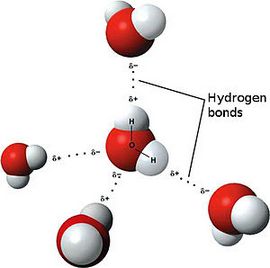
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке — Covalent Bond.


Спасибо огромное!
Рад, что статья оказалась полезной.
Простите, конечно, статья великолепна, но рыская по всем доступным мне ресурсам я так и не нашла что такое общественные электроны, вы точно уверены что не имели ввиду обобществленые электроны?
(Уж простите, химию только учу, но материала об общественных электронах я как ни старалась — не нашла)
Di7Zui, большое спасибо, что обратили на это внимание, да действительно, в статье была ошибка, и правильно как раз таки обобществленые электроны, а не общественные. Уже сделал исправление в статье.
Спасибо, просто и понятно! Мне кажется имеет место описка — «в молекуле кислорода атомы имеют Четыре Общие Пары электронов». По-видимому имелось в виду либо Две Общие Пары, либо Четыре Электрона.
Varam, спасибо вам за поправку и отзыв, но тут как раз нет опечатки, так как в молекуле кислорода имеется 8 электронов, а не 4. Картинка в статье это просто схематичная модель, не отображающая общее количество электронов.
Спасибо, тлолько я так и не поняла как отличить когда связь становится ионной, а когда ковалентной полярной