Химическая устойчивость вещества

Когда наука была молода, она запрещала своим рыцарям только одно — задавать вопрос «зачем мне это знать?». И не задавали — понимали: это постыдно, это табу. Но вот наука кое-чего достигла, обзавелась теорией, созрела, и табу размножились. Ведь каждое крупное достижение теории вводит в науку свои запреты. Открыли закон сохранения энергии, он же первое начало термодинамики,— закрыли «тематику» тех, кто изобретал перпетуум мобиле, вечные двигатели; объяснили суть Периодического закона — подрезали крылья всем, мечтавшим открыть элементы полегче гелия, но потяжелее водорода; додумались до волновой природы элементарных частиц — разбили надежды тех, кто пытался измерить точную скорость электрона.
Знание назубок всех табу — это, пожалуй, и есть тот признак, по которому отличают ученого-профессионала от дилетанта: тот, для кого физика — профессия, с вечным двигателем не возится. Но сколько же дилетантизма порождает на свет то обстоятельство, что по мере созревания науки все менее обязательным для ученого становится табу номер один — «зачем мне это знать?»! Слишком многие обзаводятся всего лишь собственными узкими полосками на необъятном поле знания — и только на ней каждый пашет, сеет, собирает урожай. А что там на соседних делянках — не его дело. Столкнувшись же с проблемой, не вписывающейся в одну делянку, узкий специалист невольно попадает в положение дилетанта. Кроме того, при этом возникают свои, местные табу. Иногда абсолютно необоснованные, но лежащие на пути науки, пока не явится решительный человек, способный пахать широко или даже пахать поперек.
Есть интересная книга — «Вечное движение», поучительная история безумной идеи перпетуум мобиле, веками привлекавшей под свои знамена целые легионы искусных изобретателей, маньяков и шарлатанов. И ясно следует из этой истории, что не один только вред принесли науке бесчисленные варианты навязчивой идеи. Ломая над ней головы, энтузиасты по ходу дела изобрели немало действительно полезных вещей. В моей науке, химии, тоже есть свои задачи, слывущие неразрешимыми, но тем и привлекающие гордые умы, свои «вечные двигатели», иногда несбыточные, иногда реализуемые, но на поверку вовсе не вечные, — так же как никогда не останавливавшиеся часы одного хитроумного англичанина, подзаводившиеся движением ртутного столба в барометре. Вот об этой борьбе за невозможное, видимо, неизбежной в любой области знания, я и расскажу.
Вещество, которого быть не должно
Возможна ли молекула, в которой атомы углерода расположены вот так:
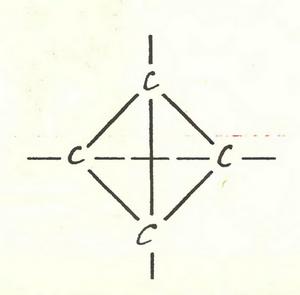
Во-первых, углы между связями тут слишком малы — велико напряжение связей, молекула его не выдержит. Во-вторых, те же атомы можно расположить иным, более устойчивым образом. Вот они и расположатся, вас не спросят. Ну а третье, самое главное,— до сих пор таких молекул не мог получить никто, хотя за дело брались не дураки. Выходит, их быть не должно.
Возражения такого рода долго приходилось выслушивать энтузиастам, пытавшимся синтезировать тетраэдран — вещество, в молекуле которого четыре атома углерода образуют правильную пирамиду.
В точности те же резоны обрушивались на мечтателей, грезивших о циклобутадиене — веществе, молекула которого имеет вот такой каркас:
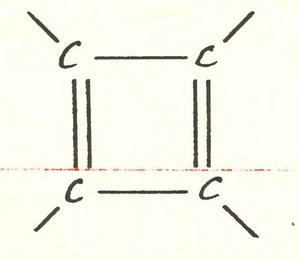
Вдобавок удручали этих мечтателей еще одним, действительно серьезным доводом. Теория запрещает такую комбинацию из двойных и ординарных связей. Одна из двойных обязательно будет разорвана, и молекула обретет свойства свободного радикала. А большинство радикалов существует лишь ничтожные доли секунды. Значит, и циклобутадиена быть не должно.
Тем не менее и тетраэдран, и циклобутадиен после многолетних мучений и споров все же были синтезированы. Удалось подобрать такие группы атомов; с которыми атомы углерода связаны своими четвертыми валентностями (на схемах эти группы не показаны), так что вещества получились сравнительно устойчивыми. Невозможное оказалось возможным — этакий небольшой «вечный двигатель».
Так, может, и табу, относящееся к перпетуум мобиле, тоже удастся объехать?. Э, нет, законы термодинамики, запрещающие перпетуум мобиле, имеют неопровержимую силу, а здесь были табу местные, если хотите, ведомственные. Да и обошли их, честно говоря, лишь условно: эти героическим образом полученные соединения можно считать устойчивыми в той же степени, в какой считать вечным двигателем гироскоп, который будет вращаться неделю или даже месяц, но, в конце, концов, все равно остановится.
Когда химики говорят: вещество устойчиво, это вовсе не значит, что с ним ничего не сделается при пяти тысячах градусов или с давлением в миллион атмосфер. Мало того, это не значит даже, что вещество будет существовать вечно при комнатной температуре. В лабораторном обиходе приняты мерки простые, житейские. Если вещество считается устойчивым, это попросту означает, что оно может прожить при комнатной температуре, хотя бы несколько дней. Потому что нельзя путать между собой два совершенно различных понятия: устойчивость и способность к существованию. Если разобраться, так же, как нельзя принять за вечный двигатель любое вращающееся колесо.
Даже если химик педантично уточняет: данное соединение, мол, устойчиво при таких-то условиях, этого еще недостаточно. По-настоящему устойчивой можно считать ту группировку атомов, при построении которой энергия выделяется; и второе условие — эти атомы нельзя собрать в другую группировку, при построении которой энергии выделится еще больше, в сущности, это то же первое начало термодинамики, только приложенное к молекулам.
— Вот вам и признак! — воскликнет торопливый любитель запретов. Те вещества, молекулы которых «энергетически выгодны», синтезировать можно. А остальные — табу! Теория не велит.
Каким скучным было бы ремесло химика, если бы дело обстояло так! Конечно, законы термодинамики незыблемы, но есть у нее свойство, жизнь химиков сильно украшающее. Термодинамика совершенно равнодушна к срокам исполнения своих предписаний. Вертящееся колесо, не получающее энергии извне, неизбежно остановится. Может, через секунду, может, через год, но остановится. Энергетически невыгодная молекула тоже неизбежно распадется с выделением «лишней» по сравнению с более выгодным состоянием энергии. Распадется. Но когда?
Такие общеизвестные соединения, как ацетилен или оксид азота (NO), термодинамически неустойчивы: энергия выделяется не при образовании их, а, наоборот, при распаде на элементы. Поэтому если просто подождать достаточно долго у баллона с ацетиленом, то никакого ацетилена в нем, в конце концов, не окажется, а только углерод и водород. Почему же ацетилен существует? Да потому, что на такое «ожидание у баллона» не хватит человеческой жизни: распад ацетилена идет чрезвычайно медленно. Вещества, в житейском смысле устойчивые, а в термодинамическом — нет, весьма распространены. Их называют метаетабильными, или кинетически устойчивыми (от имени кинетики — науки о скоростях реакций).
К числу таких «житейски устойчивых» принадлежат и тетраэдран с циклобутадиеном, о которых шла речь. Получившие их химики сумели сильно замедлить их переход в другие, энергетически выгодные системы. Вот и весь секрет.
Нередко говорят, что синтез — не столько наука, сколько искусство. Так не в том ли это искусство состоит, чтобы балансировать между термодинамикой и кинетикой? Пожалуй, да. Что может помешать химику, способному подобрать подходящие условия синтеза и последующего хранения вещества, изготовить почти любую молекулу, изображение которой нарисует его фантазия? При искусно подобранных условиях вещество окажется осязаемым, существующим, неустойчивое окажется (условно) устойчивым, и в житейском смысле слова окажется реализуемым почти любой химический «перпетуум мобиле». И как раз в этом таится серьезная опасность.
«Зачем мне эта теория!»
Структурную формулу хорошо известного углеводорода бензола можно изобразить так:
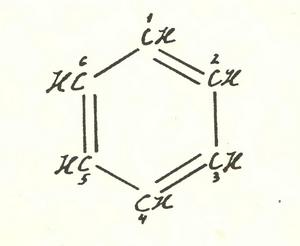
Или так.
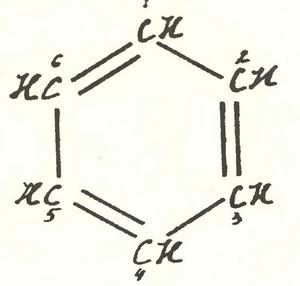
В первом варианте двойные связи соединяют атомы углерода, обозначенные номерами 1 и 2, 3 и 4, 5 и 6. Во втором — 2 и 3, 4 и 5, 6 и 1. Разные формулы? Разные. Значит, им должны соответствовать разные вещества. До этого додумались еще в позапрошлом веке, и на разделение «изомеров» если не самого бензола, то его родственников — изомеров, соответствовавших двум вариантам расположения двойных связей, было потрачено немало сил и искусства. Ни в одном случае ничего разделить не удалось, что и послужило доказательством отсутствия резких различий между «ординарными» и «двойными» связями в бензольном кольце.
А потом за объяснение природы химических связей взялись физики, которые этот экспериментальный факт обосновали. И объяснили, почему некоторые молекулы нельзя адекватно отобразить одной традиционной формулой, составленной из ординарных и двойных черточек. В иных случаях, объясняли теоретики, можно написать несколько полностью или почти равноправных формул, которые отразят свойства сложной молекулы, лишь если все эти формулы рассматривать в совокупности, вместе.
— Ну, это вы бросьте! — вот какова была реакция многих химиков-экспериментаторов на заявление физиков.— Если формулы разные, так и вещества разные.
И снова начались героические, но бесплодные попытки разделить то, что не разделяется,— несуществующие изомеры вещества, состоящего из совершенно одинаковых молекул.
А причина? То самое узковедомственное убеждение, будто истинная химия состоит только в подборе магических условий, при которых любое вещество, формулу которого измыслил химик, будет устойчивым. А всякие теории — от лукавого. Опасность, о которой только что говорилось: даже самый блестящий экспериментатор, если ему нет дела до теорий и прочей «философии», рискует превратиться в изобретателя-маньяка. Чем бы он ни занимался, механикой, химией или селекцией растений.
А вот еще одна опасность: экспериментатор делает истинное, крупное открытие, находит ему удовлетворительное — в рамках своей «делянки» — объяснение, а потом заявляет, что обнаружил закон природы, отменяющий все действовавшие ранее законы. Так случилось в конце позапрошлого века с крупнейшим физикохимиком Вильгельмом Оствальдом.
Изучая поведение кислот, щелочей и солей в водных растворах, С. Аррениус, В. Оствальд и их сподвижники доказали, что эти вещества способны распадаться на заряженные частицы — ионы. Были выведены математические закономерности. Они четко связывали поведение ионов с энергией, выделяющейся при взаимодействии вещества и растворителя. Из этих и других абсолютно верных фактов и частных обобщений Оствальд сделал вывод о том, что… никаких атомов и молекул вообще не существует, а существует только энергия. Закрыл, так сказать, атомно-молекулярное учение.
Еще одна история, связанная с физической химией. Весной 1914 года молодой, вскоре погибший на войне английский физик Г. Мозли буквально за несколько минут доказал, что редкоземельный элемент кельтий в природе не существует. На «открытие» кельтия французский химик Ж. Урбен потратил несколько лет упорного труда, Мозли же, едва взглянув на рентгеновский спектр образца, этот элемент «упразднил»: в спектре не было ни одной новой линии, кельтий представлял собой смесь ранее известных металлов.
Это был один из триумфов спектроскопии. С тех пор спектроскопических методов в химии стало много, и побед с их помощью одержали неисчислимое множество, но были и свои издержки. У некоторых химиков, совращенных быстродействием и сравнительно малой трудоемкостью этих методов, появилась тенденция «заменять вещество пиками» — вопреки вековым традициям химии не выделять его в индивидуальном виде, а ограничиваться записью спектроскопических характеристик. Конечно, таким путем можно быстро доказать, что вещество с такой-то формулой в образце действительно есть, но, во-первых, тут недолго и впасть в ошибку, а во-вторых, реальные свойства вещества — его устойчивость, индивидуальные особенности поведения — при такой работе остаются за бортом. И не раз случалось так, что важные теоретические выводы делали на основе ошибочно истолкованного спектра, что соединение, о синтезе которого победоносно сообщали, оказывалось лишь одним из компонентов неразделимой смеси. Вот еще одна грань все того же исконного греха: преувеличение, обожествление возможностей того или иного чудотворного метода.
Ну куда тут денешься от широкой теории?
Притча об отвертке
Химический синтез, хитроумные методы спектроскопии, теоретические построения все это инструменты исследования. Конечно, плох работник, который не знает о существовании того или иного инструмента, но разве этим дело ограничивается? Разве назовешь мастером того, кто забивает гвозди стамеской или сверлит отверстия отверткой? Понятно, что каждый инструмент пригоден только для определенного вида работ. Первый признак, по которому можно отличить ученого от дилетанта, уже был назван — знание назубок табу, накопленных наукой за века своего развития. Однако этот признак, как говорят математики, необходимый, но недостаточный. Большинство табу можно сравнить с запрещающими знаками уличного движения — где-то они появляются, а дальше, спустя сколько-то метров или километров, появляется знак отмены запрета. Так вот, ученому надо знать не только о существовании табу, но и о границах их действия.
Такое знание не всегда дается в готовом виде — поиски границ всегда были самой заманчивой частью изысков экспериментаторов, и порой знанию предшествует чутье. Откуда знал П. Эрлих, что среди соединений мышьяка обязательно найдется «магическая пуля», убивающая зловредную бациллу? Откуда знал А. Байер, что краситель индиго обязательно удастся синтезировать искусственно? Да не могли они этого знать, но чувствовали, верили в свои силы и в могущество химии.
Автор: П. Савко.


будущее за химией