Алканы – определение, строение, физические и химические свойства
Содержание:
Определение
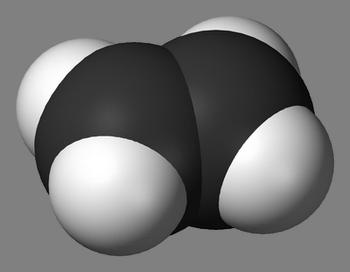
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей. Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей. Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула
Формулу алкана можно записать как:
СnР2n+2
При этом n больше или равно 1.
Изомерия
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.
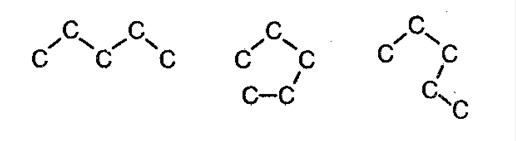
Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.
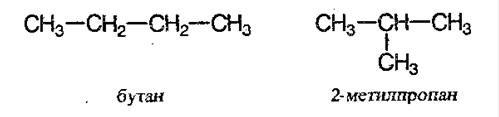
Получение
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи. То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны. А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы. И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.
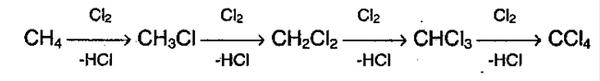
Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).
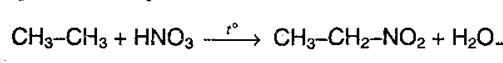
Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.
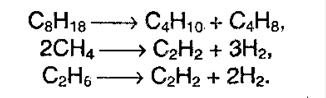
Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Практическое применение
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.

