Электролитическая диссоциация: теория и основные положения
Содержание:
История открытия
История открытия такого интересного явления в химии как электролитическая диссоциация началась в 1887 году, когда шведский химик Сванте Аренниус во время исследований электропроводности водных растворов, высказал предположение, что в подобных растворах вещества могут распадаться на заряженные частицы – ионы. Ионы эти пребывают в движении, передвигаясь к электродам, как положительно заряженному катоду, так и отрицательно заряженному аноду. Этот процесс распада и получил название электролитической диссоциации, именно он является причиной появления электрического тока в растворах.
Теория диссоциации
Классическая теория электролитической диссоциации, разработанная первооткрывателем С. Аренниусом совместно с В. Освальдом, прежде всего, предполагала, что распад молекул на ионы (собственно диссоциация) происходит под действием электрического тока. Впоследствии выяснилось, что это не совсем так, поскольку было выявлено существование ионов в водных растворах, независимо от того, проходил через них ток или нет. Тогда Сванте Аренниус сформировал новую теорию, суть ее заключается в том, что электролиты самопроизвольно распадаются на ионы под воздействием растворителя. А уже наличие ионов создают идеальные условия для электропроводности в растворе.
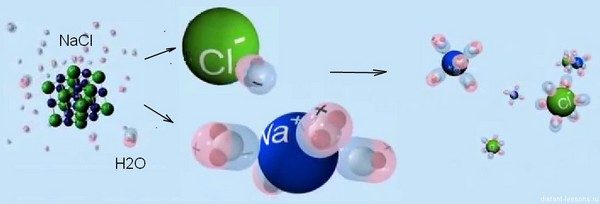
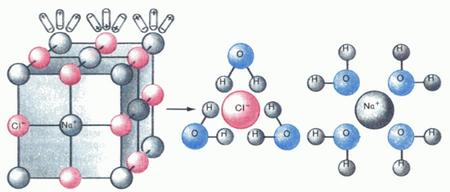
Примерно так выглядит электролитическая диссоциация схематично.
Большое значение электролитической диссоциации в растворах заключается в том, что она позволяет описывать свойства кислот, оснований и солей, и далее мы детально на этом остановимся
Диссоциация кислот
Кислотами принято считать электролиты, при диссоциации которых в качестве катионов, образуются исключительно катионы водорода.
Н3РО4 ⇄ Н + Н2РО—4(первая ступень)
Н2РО4 ⇄ Н + НРO2—4 (вторая ступень)
Н2РО4 ⇄ Н+ PОЗ—4 (третья ступень)
Так выглядят химические уравнения электролитической диссоциации кислот. В примере показана электролитическая диссоциация фосфорной кислоты Н3РО4 которая распадается на водород H (катион) и ионы анодов. Причем диссоциация много основных кислот проходит, как правило, только по первой ступени.
Диссоциация оснований
Основания отличаются от кислот тем, что при их диссоциации в качестве катионов образуются гидроксид-ионы.
Пример уравнения химической диссоциации оснований
KOH ⇄ K + OH—; NH4OH ⇄ NH+4 + OH—
Основания, которые растворяются в воде, называют щелочами, их не так уж и много, в основном это основания щелочных и щелочноземельных металлов, таких как LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2
Диссоциация солей
При электролитической диссоциации солей в качестве катионов образуются металлы, а также катион аммония NH4, а анионами стают кислотные остатки.
(NH4)2SO4 ⇄ 2NH+4 + SO2—4; Na3PO4 ⇄ 3Na + PO3-4
Пример уравнения электролитической диссоциации солей.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.


Вы занимаетесь популяризацией науки? Зачем просто перепечатываете выжимки из школьных учебников? Пишите интересные статьи. К примеру в разделе «химия» при очень выборочном беглом просмотре есть такие. Пусть статей будет не очень много, но интересные. А то размывается инфа. Я даже много страниц просто не пролистал. А если уж не втерпеж передрать школьный учебник (тогда не понятна ваша роль как популяризатора), то пишите интересные примеры и не тиражируйте порой встречающиеся неточности (не знаю кто их автор-недоделанные учебники или неточности выжимок)