Комплексные соединения
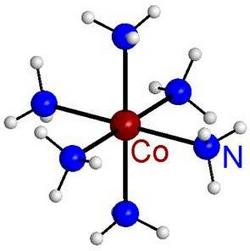
Термин «комплексные» означает «сложные». В отличие от простых соединений большинство комплексов построено не непосредственно из атомов, а из готовых молекул, которые могут существовать и самостоятельно. Комплексное соединение состоит из центрального атома металла и присоединенных к нему молекул или ионов лигандов (от латинского лигаре — связывать). Они располагаются вокруг центрального атома по строго определенной для каждого соединения схеме; это явление называется координацией. Обычно лиганды занимают места в вершинах какой-нибудь геометрической фигуры.
Например, четыре лиганда могут располагаться по вершинам воображаемого квадрата или тетраэдра. Иногда силуэт лиганда напоминает краба — такие соединения называют клешневидными. Строение других соединений можно сравнить со спрутом, который протянул к жертве свои щупальца. Каждое «щупальце» заканчивается атомом, присоединенным к металлу. Подобным лигандам дали название комплексонов. Они отличаются высокой стойкостью. Вообще, чем больше связей между лигандом и металлическим сердцем комплекса, тем более прочно соединение.
Исследователей уже давно интересовала природа сил, которые удерживают лиганды около атомов металла. Строение комплексных соединений противоречило традиционным представлениям о валентности атомов; оно казалось сначала исключением, настоящим чудом химического мира. Некоторые ученые даже определили этот класс веществ как «соединения, которые не подчиняются обычным правилам валентности». В самом деле, валентность металла в некоторых комплексах должна была бы выражаться двузначным числом! Еще и сейчас для науки тут не все ясно: загадка образования ряда комплексных соединений остается нераскрытой.
Однако в ряде случаев на вопрос о силах комплексообразования уже можно дать совершенно определенный ответ. Иногда это силы обычного электростатического притяжения между центральным ионом металла, заряженным положительно, и лигандами, которые несут отрицательный заряд или имеют диполь (два противоположных заряда, расположенных на определенном расстоянии). Так построены комплексные фториды, некоторые кислородные соединения.
Кроме того, часто между центром комплекса и его «окружением» существует ковалентная связь — когда атомы отдают по электрону на «общее пользование». В результате образуется электронная пара; она взаимодействует с обоими атомами и соединяет их. Количество «коллективных» электронов, «обслуживающих» весь комплекс, может быть и значительно большим. Тогда они образуют электронное облако, которое охватывает весь комплекс, не давая ему распасться на составные части.
Комплексное соединение — очень сложное «содружество», в нем каждый из «союзников» испытывает влияние своего соседа. При замене лигандов строение центрального атома металла меняется. Одни электронные орбиты его сжимаются и становятся энергетически невыгодными, другие расширяются и становятся более выгодными. Электроны лиганда могут перейти на орбиты атома металла, а электроны металла — на орбиты лигандов. Одним словом, все составные части комплекса перестраиваются, приспосабливаясь к совместному существованию.
Эти невидимые события электронного мира сразу же становятся зримыми и ощутимыми, так как они меняют свойства комплексных соединений. Скажем, делают их растворимыми в одних жидкостях и нерастворимыми в других, придают им новую окраску, новые электрические и магнитные свойства. Таким образом, комбинируя атомы металлов с разными атомами, ионами, молекулами, способными выступать в роли лигандов, можно получать необычные и иногда очень ценные вещества. И число таких комбинаций может быть как угодно большим.
Рассмотрим теперь некоторые примеры практического использования комплексных соединений. Каждому, кто занимался фотографией, известно, что изображение на пленке и на фотобумаге обязательно нужно фиксировать. Малорастворимое бромистое серебро при этом растворяется в тиосульфате натрия, образуя сложное соединение — тиосульфатный комплекс. Изображение становится четким и стойким».
Много неприятностей доставляет нам «жесткая вода» из-за образования накипи — осадка нерастворимых соединений кальция, магния и железа. Между тем этой неприятности можно избежать, если связать ионы металлов в комплексы. Лигандами для таких комплексов могут служить, например, полифосфаты, а также упоминавшиеся ранее спрутообразные комплексоны.
Особое внимание исследователей привлекает сейчас проблема использования комплексных соединений в биологии и медицине. Для нормальной жизнедеятельности организмов необходимы ионы. Но лишь некоторые из них, попав в организм, достигают пунктов своего назначения: на всем пути продвижения им угрожает опасность встретить ионы-осадители с противоположными зарядами. Если это произойдет, ион металла оказывается утраченным для организма.
Химики нашли остроумный выход из этого положения; предложили связывать нужные ионы металла в комплексе. В виде соединения с лигандом ион легко достигает любой точки организма; лиганд становится как бы надежным кораблем, на котором ион металла, защищенный от действия против ионов, путешествует по организму. Таким способом можно, например, бороться с распространенной болезнью растений — хлорозом, вызываемым недостатком ионов железа. Если в почву внести соединения, которые могут выполнять роль лигандов, то железо, всегда находящееся в почве, образует с ними стойкие комплексы и в таком виде легко проникает в ткани растений. Хлороз излечивается.
Людям издавна известно бактерицидное действие некоторых ионов металлов, например, способность серебра в малых концентрациях обеззараживать воду. Казалось бы, таким путем можно разрешить проблему лечения многих заболеваний. Однако дело усложняется двумя серьезными обстоятельствами: во-первых, ионы металлов «на пути» к вирусам и бактериям могут встретить противоположно заряженные ионы и выпасть в осадок; во-вторых, ионы металлов вредны не только для вирусов и бактерий, но и для самого организма, который они должны «охранять». Если подобрать подходящий лиганд, можно одновременно расправиться с обоими препятствиями. Какой же лиганд нужен для этой роли? Требования к нему достаточно велики: комплексы, образованные им, должны разрушаться лишь при встрече с белками бактерий или вирусов, чтобы «выстрелить» по ним смертоносным зарядом — ионом металла, но в то же время они должны остаться неизменными при встрече с молекулами белков больного организма. Другими словами, комплекс должен быть достаточно прочным, чтобы быть безвредным для человека, и достаточно непрочным, чтобы, распадаясь, убивать вирусы и бактерии.
Здесь многое обещают эксперименты с комплексами железа и оксихинолина, имеющими сильное бактерицидное действие. Ион железа может присоединять несколько частичек оксихинолина, однако убивать микроорганизмы способны лишь комплексы с одной частичкой. Этой частички вполне достаточно, чтобы благополучно «доставить» ион железа к месту назначения — белку микробной клетки,— и в то же время эта частичка легко отделяется, как только справится со своей ролью «средства связи».
Еще одно перспективное направление использования достижений химии комплексных соединений — химическая технология.
Мы уже говорили, объединение с атомом или ионом металла существенно отражается на свойствах лиганда. Его электронные орбиты перестраиваются, во многих местах молекула становится рыхлой, более доступной для взаимодействия с другими частичками. Именно на этом явлении основывается целый ряд химических реакций, которые проходят при участии металлов-катализаторов. Причем ионы металлов оказывают каталитическое действие даже при неуловимо малых концентрациях: уже 12 грамма (0,000000000001!) некоторых металлов в одном миллилитре заявляют о своем присутствии значительным ускорением химического взаимодействия. Некоторые чистые вещества вообще не реагируют одно с другим, и лишь внесение небольших доз солей металлов вызывает реакцию.
Комплекс органических производных алюминия и треххлористого титана чудодейственно влияет на газ этилен; уже при обычной температуре и обычном давлении комплекс заставляет его полимеризоваться, превращаться в твердый, очень ценный материал полиэтилен.
Катализаторы — комплексные соединения — интересуют исследователей еще и потому, что некоторые из них представляют собой простейшие, удобные для изучения модели сложных биологических катализаторов-ферментов. Кстати, зеленый цвет листьев растений связан с присутствием в них хлорофилла — комплексного соединения порфирина с магнием, а кровь обязана своим красным цветом другому комплексному соединению — гемоглобину.
Яркая окраска отличает многие комплексные соединения. Объясняется это явление сменой энергетических уровней в молекулах лигандов: когда они сближаются, вещество из бесцветного становится окрашенным, а окрашенное изменяет свой цвет. Как красители комплексные соединения удовлетворяют самым высоким требованиям: они ярки, стойки к действию солнца, влаги, температурных колебаний.
Химия комплексных соединений была одним из самых малоизученных разделов современной химии. Теперь положение меняется: химики поняли, что этот класс соединений очень важен для науки и практики. Уж один тот факт, что для некоторых элементов комплексных соединений известно больше, чем простых, говорит об их месте в окружающем нас мире.
Автор: К. Яцимирский.

