Історія відкриття бензолу
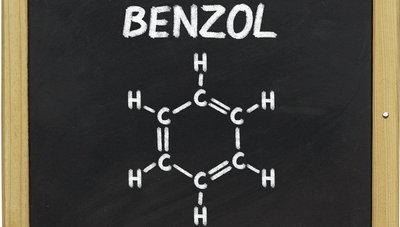
У 1865 році видатний німецький хімік Август Кекуле після довгих і болісних пошуків встановив першу структурну формулу бензолу. Це відкриття було виключно важливим: у першому наближенні розкрилася будова молекули бензолу, а разом з нею і всіх її похідних, що грають надзвичайно важливу роль в органіко-хімічному виробництві. Цей клас органічних речовин (ароматичних) довгий час вперто не піддавався теорії хімічної будови. І тільки завдяки відкриттю Кекуле цей науковий бастіон був узятий.
Багато змін зазнала формула Кекуле за минулий час, але основа, принцип її побудови — її циклічний характер — зберігається незмінним. Варіювалися і, ймовірно, ще не раз будуть змінюватись лише її деталі.
Спробуємо тепер проаналізувати механіку відкриття Кекуле і, порівняємо її з іншими відкриттями, схожими з ним в сенсі логічної побудови, з’ясувавши деякі загальні шляхи наукової творчості.
У чому ж полягає вирішальний етап наукового відкриття?
Суть відкриття Кекуле
Ще в 50-х роках XIX століття Кекуле встановив три важливих теоретичних положення, що стосуються будови органічних (вуглецевих) сполук:
1) чотирьохвалентність вуглецю (С).
2) здатність атомів карбону з’єднуватися між собою і утворювати відкриті ланцюги.
На основі цих положень в 1861 році А. М. Бутлеров створив теорію хімічної будови. Їй підкорявся весь ряд жирних сполук. Але ось ряд ароматичних сполук, здавалося б, випадав з кола нових уявлень. Найпростіший і найважливіший його представник — бензол — виявляв дивну особливість: його молекула складалася з шести атомів вуглецю і шести атомів водню, причому всі його монозаміщені не давали ізомерів. Іншими словами, який б водень в бензолі не був заміщений, скажімо, на хлор (при хлоруванні бензолу) або на нітрогрупу (при нітруванні), в результаті завжди виходив один і той же хлорбензол або один і той же нітробензол.
Це означало, що у бензолу всі шість атомів водню абсолютно однакові між собою на відміну, наприклад, від пентану, де при заміщенні одного водню на хлор можуть утворитися три різні ізомери.
Всі спроби представити будову бензолу, виходячи з прийнятих вже теоретичних положень, закінчувалися безрезультатно. Якщо є шість атомів вуглецю, то, очевидно, 18 одиниць валентності йдуть у них на взаємне їх насичення, а решта 6 одиниць — на з’єднання з шістьма атомами водню.
Проте легко помітити, що у всіх цих випадках не виконується умова рівноцінності всіх шести атомів водню в молекулі бензолу, оскільки атоми водню, що стоять біля атомів вуглецю всередині ланцюга, завжди будуть відмінні від атомів водню, що стоять біля атомів вуглецю по її краях. Тим не менше рішення задачі хіміко-органіки, в тому числі і сам Кекуле, наполегливо шукали в площині тої чи іншої ланцюгосхожої будови бензолу.
Сила інерції думки була настільки велика, що здогад про можливості в принципі іншої будови сполук, крім ланцюжка, навіть не зароджувалася. Одного разу, перебуваючи в Лондоні, Кекуле їхав в омнібусі і зазвичай думав про будову бензолу. Випадково його увагу було залучено кліткою з мавпами, яких везли кудись в цирк або звіринець. Мавпи стрибали, зчіплювалися одна з одною лапами, утворюючи як би інші кільця. І тут же у Кекуле народилася асоціація: мавпи — атоми вуглецю, їх лапи — валентності, якими атоми зчіплюються між собою, а їх хвости — ті вільні валентності вуглецю, які насичуються воднем. Головною ж була сама ідея: атоми вуглецю можуть утворювати замкнені ланцюги! Саме цим і було прорване закріплене коло уявлень про те. що з’єднання атомів вуглецю може бути лише одним — ланцюгоподібним.
Як тільки виникла нова ідея про вуглецеве кільце, так негайно прийшло і саме рішення задачі, що так довго мучила розуми хіміків. Справді, треба відразу прийняти, що, принаймні, дві одиниці валентності у кожного атома вуглецю йдуть на утворення зв’язків із сусідніми атомами вуглецю в кільці бензолу (це, як мінімум, необхідно для того, щоб могло утворитися кільце); третя її одиниця у кожного вуглецю, очевидно, повинна йти на з’єднання з воднем.
Четверта одиниця валентності залишається поки ще не пов’язаною. Однак, враховуючи здатність карбону утворювати подвійні зв’язки, легко допустити, що залишилися вільними 6 одиниць валентності вуглецю у попарно взаємно насичених і утворюючих три подвійні зв’язки, що чергуються з трьома ординарними. Звідси виводиться остаточна формула. Виходила сувора шестиосная симетрія для всіх шести атомів вуглецю, а значить, і повна рівноцінність усіх шести атомів водню.
Так було зроблено одне з найбільш чудових відкриттів в історії органічної хімії. Пізніше були запропоновані варіанти цієї формули, що намагалися усунути її недоліки, але всі вони в основі своїй мали формулу Кекуле.
Автор: Б. Кедров.

